我的器官都在说谢谢我减重 全民慢病健康科普计划
肥胖可以说是万恶之源。
肥胖跟2型糖尿病、高血压、血脂异常和冠心病相关;而且还直接增加死亡风险。BMI越高,出现并发症和死亡的风险越大[1]。
来自美国CDC的监测系统提示,减重可以降低糖尿病、高血压、冠心病等疾病的并发症、死亡风险[2];
比如,糖尿病预防项目(Diabetes Prevention Program, DPP)中,减重的强化生活方式干预降低了在3年内由糖耐量受损进展为糖尿病的发生率[3]。
尽管体重减轻>5%即可带来健康获益[3],而减少死亡风险、减少心血管风险的体重控制主要发生在>10%的人群[4]。
很可惜的是,基于运动+饮食控制的单纯生活方式干预往往只能让体重下降7%-10%,且往往难以长期维持[5]。(这里的长期是指超2年)
仅仅生活方式干预的降低体重,在降低心血管事件和死亡风险方面几乎是无意义的[6]。其原因可能是体重下降幅度不够大(<10%),远期的体重反弹(2年后),以及其他干预让心血管死亡风险降低(比如他汀类降血脂)[6]。
为什么生活方式干预在体重降低幅度方面不够理想,且不能长期维持呢?
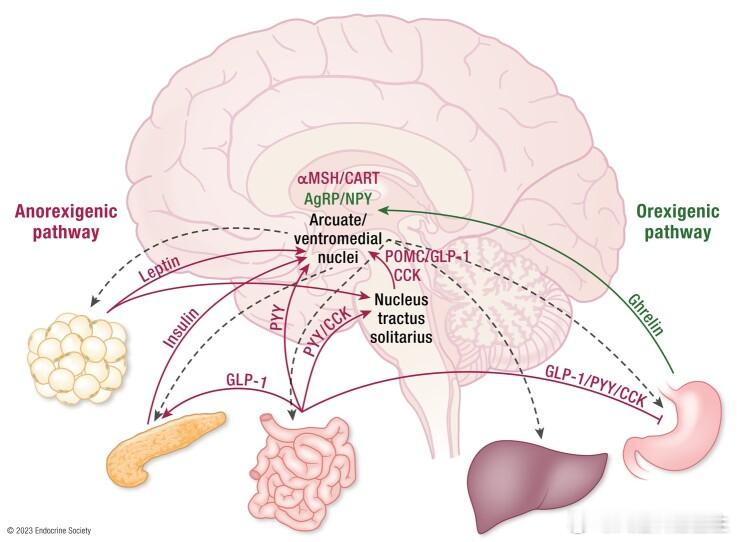
这可能是人体有强大的体重调定的神经激素网络。
食欲和体重是通过促食欲激素(如生长素释放肽、神经肽 Y)和厌食激素(如瘦素、胰岛素)的作用来维持的,它们通过多个神经内分泌网络相互作用[7];
图1:调控食欲和体重的神经激素网络。
这种相互作用的结果就是:我们的身体记住了某个体重,而仅仅调整生活方式是难以远离被记住的体重。
很显然,我们要想办法打破这种“ 食欲和体重”神经激素调定网络。只有这样才能更好的控制体重,即体重下降幅度更大,体重下降的维持时间更长。
最早的让体重能普遍性下降超10%的方法是手术减肥。
在针对病理性肥胖(BMI≥40kg/m2)人群,虽然不同减肥手术的效果不一,但体重下降普遍>40%[8]。
但是,对于那些体重达不到病理性肥胖程度的,手术治疗的收益能否远超手术副反应,这是必然担心的要点。
基于此,学界普遍的共识是,对于非病理性肥胖的肥胖者(即BMI<40kg/m2)应首先尝试“运动+饮食调节”的生活方式控制来降低体重。未能实现体重下降超10%者,再考虑药物降低体重。
对于病理性肥胖者应立即考虑药物治疗,或者手术治疗。
药物治疗里目前首先推荐:基于肠促胰岛素的相关药物。
比如,
1,胰高血糖素样肽1(glucagon-like peptide 1, GLP-1)激动剂;
2,GLP-1和葡萄糖依赖性促胰岛素释放肽(glucose-dependent insulinotropic polypeptide, GIP)双受体激动剂。
目前的研究证实,这两类药物都可以让体重下降超10%[9、10],甚至部分病人体重下降超20%。而且还能让体重下降维持超68周。
初步可以预计能带来心血管风险、死亡风险的下降。而这点实际上已经在司美格鲁肽(GLP-1激动剂)治疗组得到证实。
比如,SELECT试验[11]:
该研究纳入了17,604例已确诊心血管疾病且BMI≥27kg/m2的患者,随机分配接受司美格鲁肽皮下注射(2.4mg,一周1次)与安慰剂治疗,发现司美格鲁肽组的主要心血管事件较少(6.5% vs 8%;HR 0.80;95%CI 0.72-0.90)。该研究平均随访时间为 39.8 个月。
结论是:司美格鲁肽每周2.4mg皮下注射,降低心血管原因导致的死亡、非致死性心肌梗死或非致死性中风的复合发生率方面优于安慰剂。
请注意,该研究组的病人没有糖尿病。
类似的还有 STEP-HFpEF 和 STEP-HFpEF DM 试验[12]:
STEP-HFpEF试验:没有糖尿病的射血分数保留型心衰病人;纳入治疗组有529 人。
STEP-HFpEF DM 试验:有糖尿病的射血分数保留型心衰病人;治疗组有616 人。
572 名分配到安慰剂组的参与者。
中位随访时间为 401 天;
结论是:
从基线到第 52 周,相应的体重平均减少是司美格鲁肽组 12·0 kg (SD 7·7),安慰剂组为 3·1 kg (7·7) (组间差异 -8·9 [95% CI -9·9 至 -8·0]);在降低体重的同时,治疗还改善心力衰竭相关健康状况、运动功能。且,无论是是否有糖尿病,司美格鲁肽都能看到显著疗效。
总之,当下我们已有良好的减肥药物来帮助我们减肥。司美格鲁肽这一类药物不但可以让我们更大幅度降低体重,更持久的降低体重,还能降低心血管病风险、减少相关死亡风险。
参考文献:
1,Jensen MD, Ryan DH, Apovian CM, et al. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. Circulation 2014; 129:S102.
2,Centers for Disease Control and Prevention. Overweight & obesity. Available at: (Accessed on March 06, 2020).
3,Knowler WC, Barrett-Connor E, Fowler SE, et al. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002; 346:393.
4,Look AHEAD Research Group, Gregg EW, Jakicic JM, et al. Association of the magnitude of weight loss and changes in physical fitness with long-term cardiovascular disease outcomes in overweight or obese people with type 2 diabetes: a post-hoc analysis of the Look AHEAD randomised clinical trial. Lancet Diabetes Endocrinol 2016; 4:913.
5,Wadden TA, Webb VL, Moran CH, Bailer BA. Lifestyle modification for obesity: new developments in diet, physical activity, and behavior therapy. Circulation. 2012 Mar 6;125(9):1157–1170. doi: 10.1161/CIRCULATIONAHA.111.039453
6,Look AHEAD Research Group, Wing RR, Bolin P, et al. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med 2013; 369:145.
7,Hoong-Wei Gan,, Manuela Cerbone , Mehul Tulsidas Dattani . Appetite- and Weight-Regulating Neuroendocrine Circuitry in Hypothalamic Obesity . Endocr Rev. 2023 Nov 29;45(3):309–342. doi: 10.1210/endrev/bnad033
8,成人肥胖治疗概述;Uptodate临床顾问
9,Jastreboff AM, Aronne LJ, Ahmad NN, et al. Tirzepatide Once Weekly for the Treatment of Obesity. N Engl J Med 2022; 387:205.
10,Wilding JPH, Batterham RL, Calanna S, et al. Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med 2021; 384:989.
11,Lincoff AM, Brown-Frandsen K, Colhoun HM, et al. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med 2023; 389:2221.
12,Butler J, Shah SJ, Petrie MC, et al. Semaglutide versus placebo in people with obesity-related heart failure with preserved ejection fraction: a pooled analysis of the STEP-HFpEF and STEP-HFpEF DM randomised trials. Lancet 2024; 403:1635.