转自:ACROBiosystems官方
新一代T细胞衔接器(TCE)的竞争已进入“深水区”,引入有效的免疫共刺激信号(第二信号),成为提升TCE疗效、特别是攻克实体瘤的关键突破口。从早期的CD28到热门的4-1BB,探索不断,但临床验证之路并不平坦:
CD28共刺激TCE:Sanofi项目I期折戟,Regeneron项目深陷安全性泥潭,实体瘤疗效提升未达预期。
4-1BB共刺激TCE:Roche血液瘤组合数据(CD19/4-1BBL+CD20/CD3)展现潜力,但其与Chugai合作的实体瘤项目(DLL3/CD3/CD137,CLDN6/CD3/CD137)仍是焦点,结果待观察。
2025AACR会议释放强烈信号:CD2-CD58通路,正成为TCE共刺激领域那颗“最亮的星”!多家头部企业集中披露进展。
为什么是CD2?
不可忽视的优势
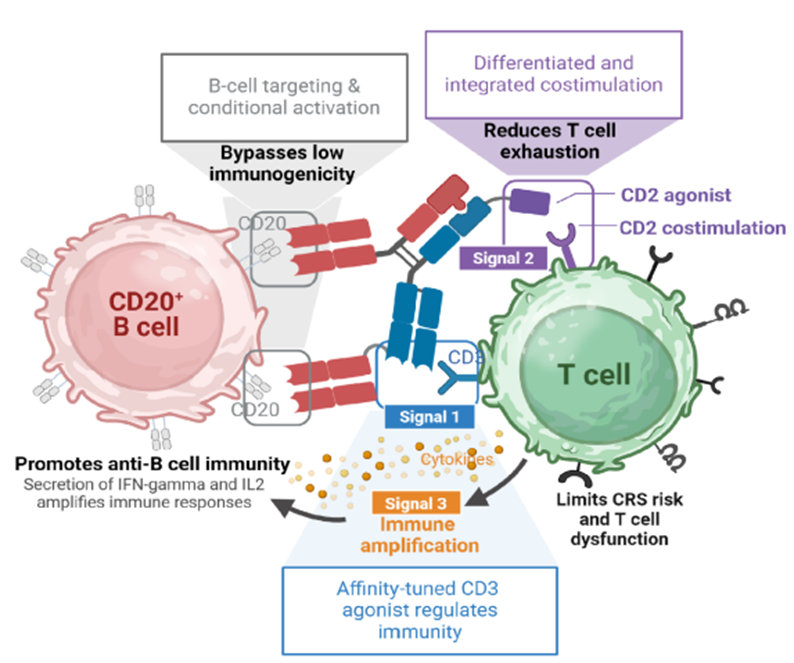
CD2(LFA-2)是表达于T细胞和NK细胞表面的关键分子,其配体CD58(LFA-3)广泛存在于抗原呈递细胞(APC)及多种体细胞表面。CD2-CD58相互作用在T细胞活化中发挥关键作用:
强效共刺激:CD2与CD58高亲和力结合后形成CD2-CD58复合物,增强T细胞与APC之间的黏附作用的同时为T细胞的活化提供共刺激信号,并促进T细胞增殖与分化。
延缓耗竭:相比CD3单信号或CD28共刺激,CD2信号能显著减缓T细胞耗竭速度,支持多轮刺激后的持续扩增——这对需要持久战斗力的实体瘤治疗至关重要!
巨头角逐:CD2共刺激TCE平台与管线扫描
诺华(Novartis):
PIT565:首个CD2共刺激TCE的临床探索
诺华的PIT565是业界首个将CD2作为免疫共刺激信号开发的三特异性抗体,靶向CD19/CD3/CD2,采用1:1:1不对称IgG-like结构,Fc段通过“knob-into-hole”技术实现重链配对。其核心创新在于CD58的工程化改造,通过引入半胱氨酸突变对提升热稳定性。体外实验表明,V54C_G88C突变体在Nalm6肿瘤细胞杀伤中活性最强,且非特异性T细胞激活显著低于全长CD58。该项目于2022年10月进入临床I期,针对NHL、B-ALL及系统性红斑狼疮(SLE),目前暂未披露临床数据。
QLSFBiotherapeutics:
双平台驱动实体瘤突破
QL535(PSMA/CD3/CD2,TECOS平台)
基于“2+1+1”三特异性结构,QL535通过PSMA靶向前列腺癌细胞,同时融合CD58激活CD2共刺激信号,这种组合克服了T细胞耗竭。
今年的AACR会议上,QLSF首次公开披露了QL535的数据,14名转移性去势抵抗性前列腺癌患者的单细胞RNA测序表明,肿瘤浸润性淋巴细胞(TILs)上,肿瘤浸润CD8+T细胞的CD2表达率显著高于CD28。体外实验中,QL535与CD28三特异性抗体相比,IL-6、TNF-α等细胞因子释放降低,且在前列腺癌患者来源的PBMC重复刺激实验中,T细胞耗竭明显延缓——其他药物因耗竭导致细胞毒性下降时,QL535仍维持肿瘤特异性溶解活性。体内模型显示,其细胞毒性与CD28三特异性相当,但安全性更优,通过微调CD3亲和力降低CRS风险。
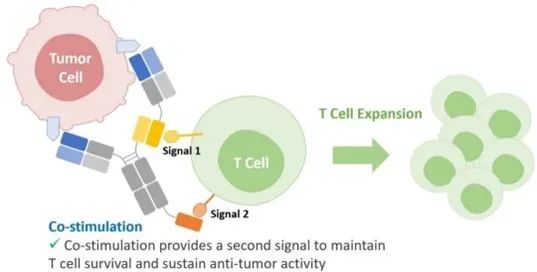
的机制(AACR2025)
QL615(EGFR/c-Met/CD3/CD2,TECAD平台)
此外,该公司还开发了一种四特异性TCEQL615,QL615通过“双抗原共靶向+CD2共刺激”策略解决实体瘤选择性问题:仅在EGFR与c-Met共表达的肿瘤细胞上激活T细胞。QL615优化了MET和EGFR结合域的亲和力,使得只有在目标细胞上双重接合时,才能提供高亲和力结合和选择性激活。细胞结合实验显示,其对双阳性肿瘤细胞的EC50达纳摩尔级,对单阳性细胞的结合可忽略不计。CD2共刺激使体外杀伤肿瘤细胞较传统CD3TCE提升约30倍,体内实验中肿瘤生长控制能力显著增强。该设计利用MET和EGFR在正常组织中非重叠表达的特性,通过“亲和力驱动结合”扩大治疗窗口,是实体瘤TCE的重要突破方向。
EvolveImmuneTherapeutics:
CD2共刺激优势验证
EvolveImmune的EVOLVE平台采用1:1:1IgG-like三特异性结构,创造了区别于现有TCE疗法的突破性机制。关键创新在于:1)CD2在100%的T细胞(含初始及耗竭T细胞)上组成型表达,解决了现有疗法因靶点表达局限(导致的免疫激活不全问题;2)CD2与配体CD58结合后直接激活Lck-Fyn激酶通路,使TCR-pMHC结合敏感度提升百倍;3)该机制可绕过肿瘤常见的CD58缺失逃逸路径,为耐药患者提供新治疗方案。2024年EvolveImmune与AbbVie达成14亿美元战略合作,推进EVOLVE-104(ULBP/CD3/CD2)等实体瘤项目。
EvotecInternational:
另辟蹊径-CD2激动剂抗体
不同于前述企业融合CD58的思路,Evotec开发了CD2激动剂抗体平台BiTco,可在肿瘤细胞CD58缺失(常见逃逸机制)时仍提供共刺激。多种实体瘤的单细胞测序表明,部分肿瘤浸润T细胞高表达CD2但不表达CD28,而BiTco可特异性激活这类细胞。AACR2025披露数据显示,体外实验中,BiTco与亚有效剂量CD3TCE联合使用,可完全恢复抗肿瘤细胞毒性,敲除CD58后,BiTco仍能增强TCE介导的杀伤。体内BT474CDX模型显示,BiTco联合TCE可通过重建的人T细胞有效控制肿瘤生长,且细胞因子释放低于CD28共刺激组,安全性更优。该策略为CD2共刺激提供了抗体靶向的新路径。
结语:
CD2能否成为实体瘤TCE破局关键?
CD2-CD58通路作为免疫共刺激的“新贵”,在2025AACR上大放异彩,吸引了诺华、齐鲁、EvolveImmune、Evotec等知名玩家积极布局,其在覆盖广泛TILs、延缓T细胞耗竭方面的独特优势,使其在攻克TCE实体瘤难题的征途上充满想象空间。
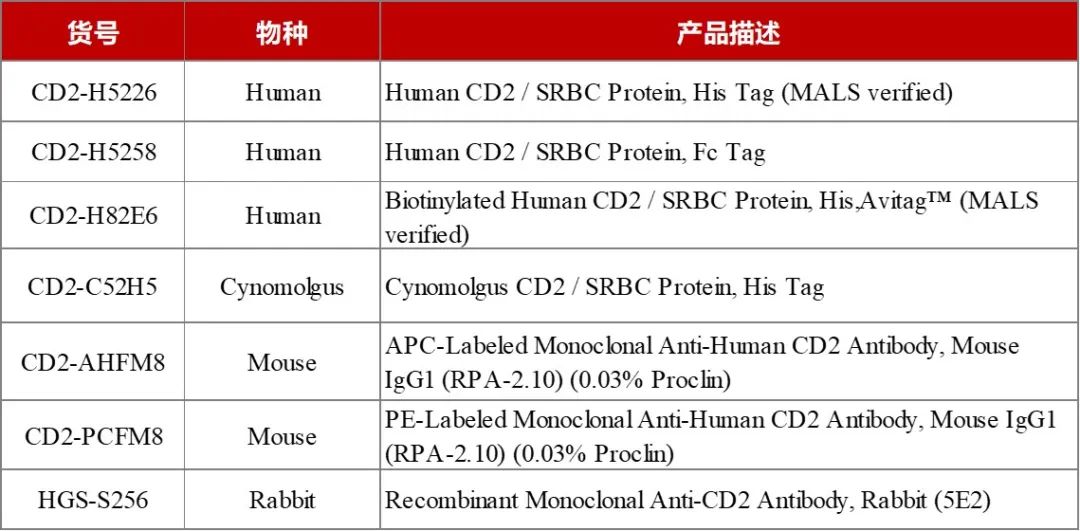
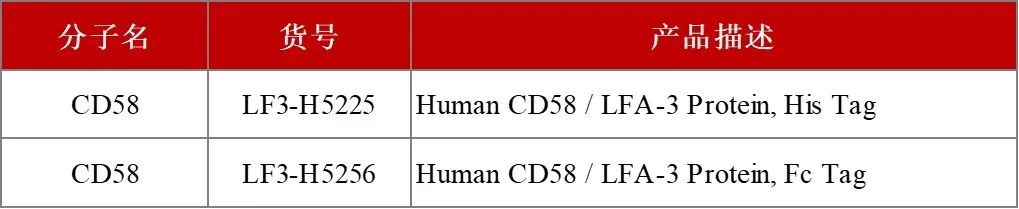
为了满足市场研发的需求,ACROBiosystems百普赛斯开发了一系列CD2蛋白,覆盖Human、Cynomolgus、Rabbit、Mouse种属,包含未标记/Biotin/PE/APC标记形式,超90%纯度经SDS-PAGE以及SEC-MALS验证,高生物活性经ELISA/BLI验证,可满足从免疫、抗体筛选和表征、功能验证到后期的生产质控全流程,协助加速CD2相关药物研发。

验证数据
蛋白均一结构及超90%纯度经SEC-MALS验证
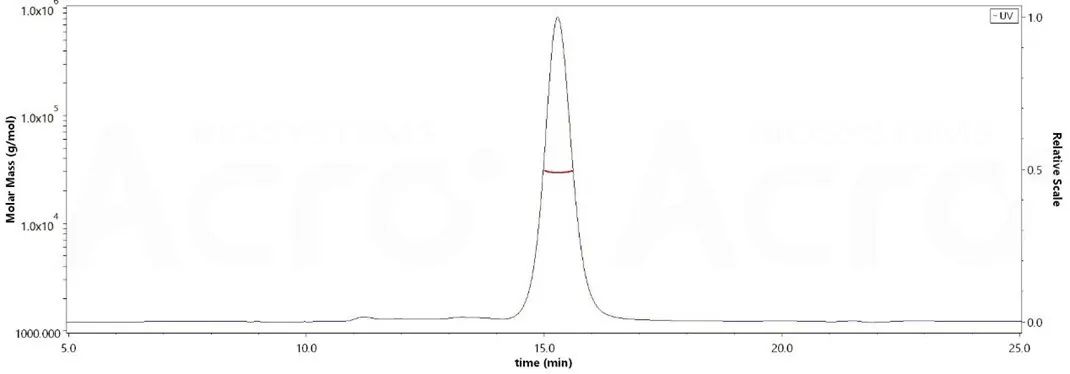
ThepurityofHumanCD2,HisTagismorethan90%andthemolecularweightofthisproteinisaround23-35kDaverifiedbySEC-MALS.
CD2蛋白与CD58的高结合活性经ELISA验证
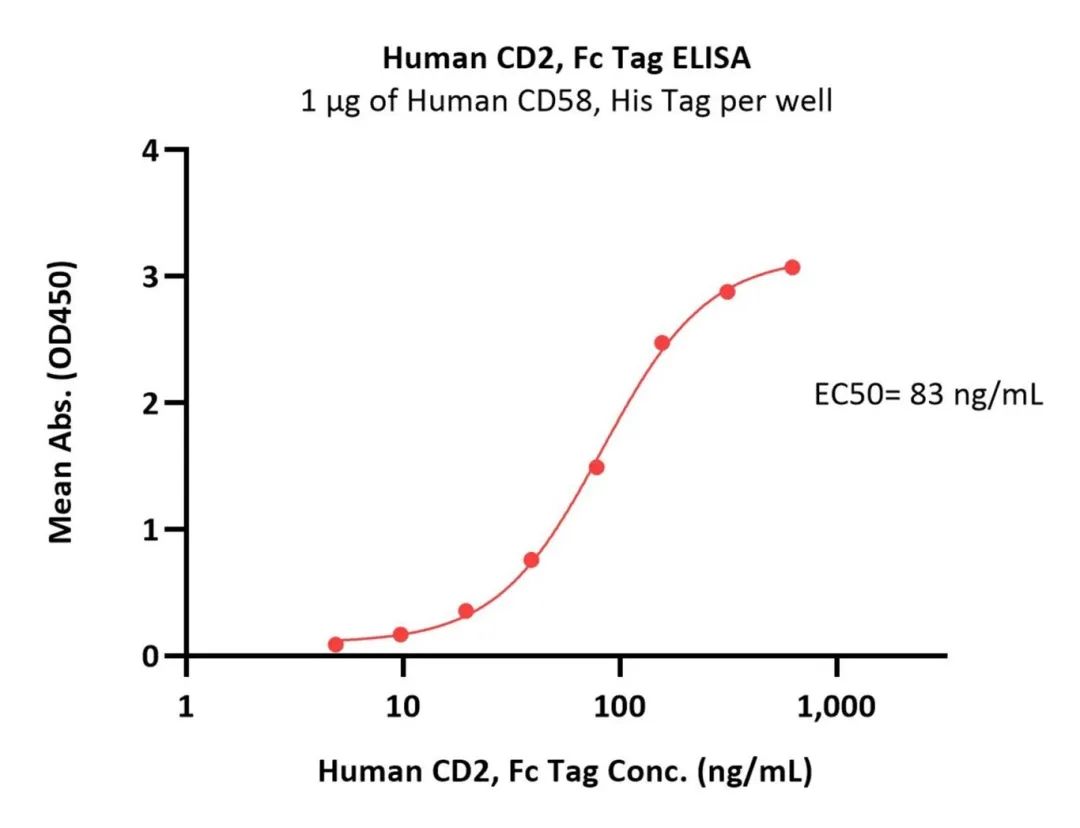
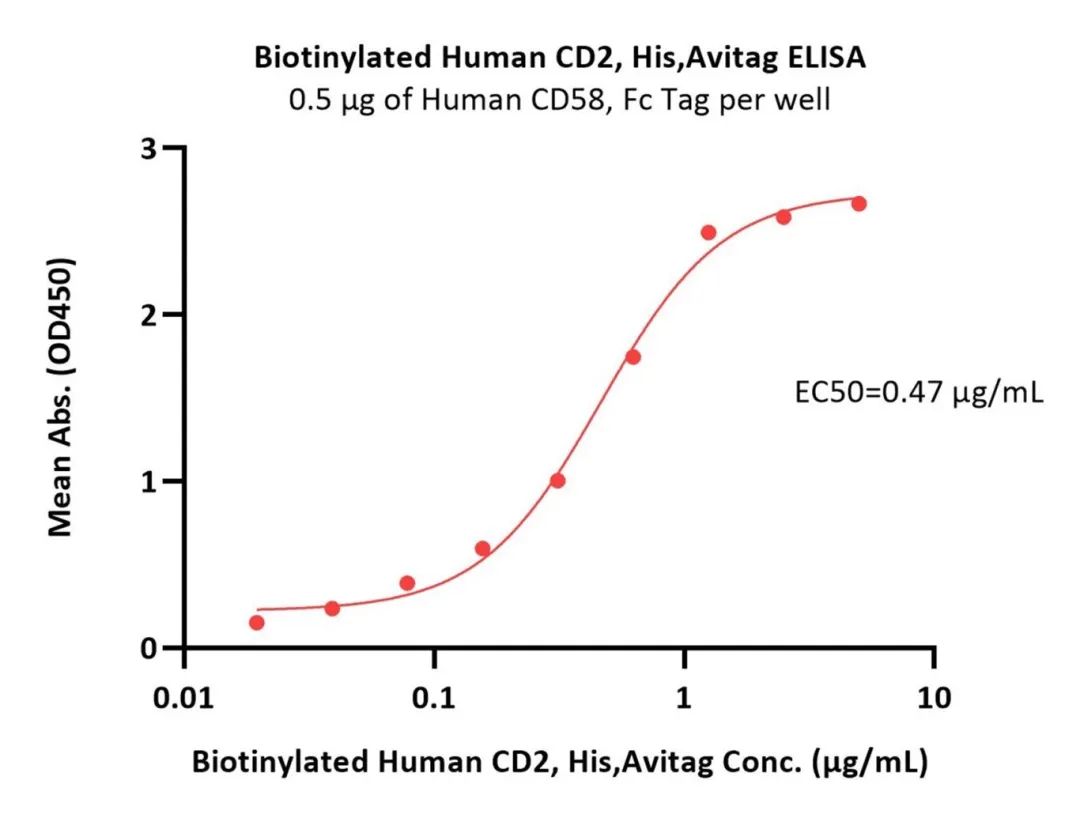
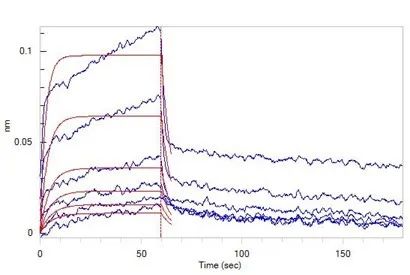
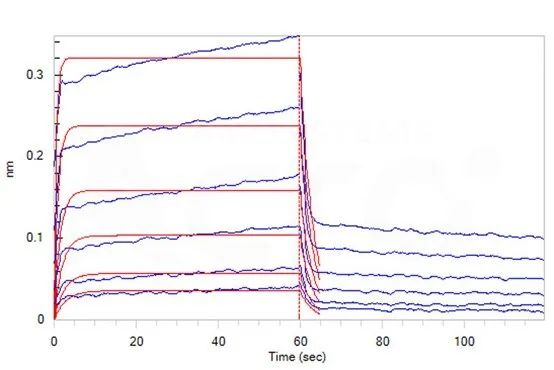
(转自:ACROBiosystems官方)






![[CDE重磅发布]细胞治疗纳入先进治疗药品范畴!](http://image.uczzd.cn/10668472909244228420.jpg?id=0)
